Защита алюминиевых конструкций от коррозии. Защитная пленка на поверхности алюминия состоит из
Ответы@Mail.Ru: Очень нужна помощь!
Отраслевая энциклопедия. Окна, двери, мебель
Благодаря превосходному соотношению плотности и механической прочности, а так же достаточно высокой стойкости к коррозии, алюминий широко применяется в строительстве, в том числе при изготовлении светопрозрачных конструкций – окон, дверей, витражей, зимних садов, и так далее. Но, несмотря на коррозионную стойкость алюминиевых конструкций, сам алюминий с точки зрения химической науки – один из самых активных металлов, вступающих в реакцию не только со щелочами и кислотами, но даже с водой. Данное противоречие объясняется тем, что под воздействием кислорода поверхность алюминия покрывается прочной, устойчивой оксидной пленкой (пассивируется), предохраняющей металл от коррозии, то есть от процесса разрушения металлов в результате химического или электрохимического воздействия.

Рис.1. Коррозия алюминиевого профиля
Коррозионная стойкость алюминия
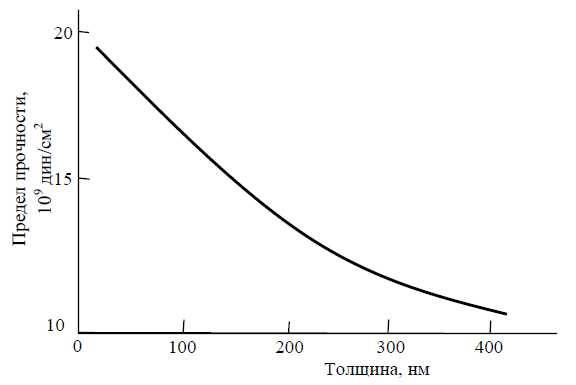
Окись алюминия создает защитный слой, толщина которого составляет 20—100Å, который химически инертен. Чистый алюминий, с поверхностью, очищенной от защитной пленки, реагирует с водой, выделяя при этом водород и создавая оксидную пленку на поверхности. Таким образом, при контакте с окислителями, поверхность алюминия пассивируется. По сути, кислород, содержащийся в воздухе или растворенный в воде, повышает коррозионную стойкость алюминия, которая, в свою очередь, в значительной степени зависит от содержания примесей других металлов. Известно, что при контакте двух металлов, в среде электролита, образуется гальваническая пара, где анодом становится более активный металл, а катодом - менее активный. В результате электрохимической реакции происходит разрушение структуры анода. Большая часть примесей (железо, свинец, медь и т.д.) играют по отношению к алюминию роль катода, способствуя его разрушению. По этой причине чистый алюминий имеет более высокую стойкость к коррозии, чем технический, который, в свою очередь, более стоек к коррозии, чем сплавы алюминия с другими металлами. Так же стойкость алюминия к коррозии зависит от характеристик внешней среды и от реакций, вызываемых этой средой.
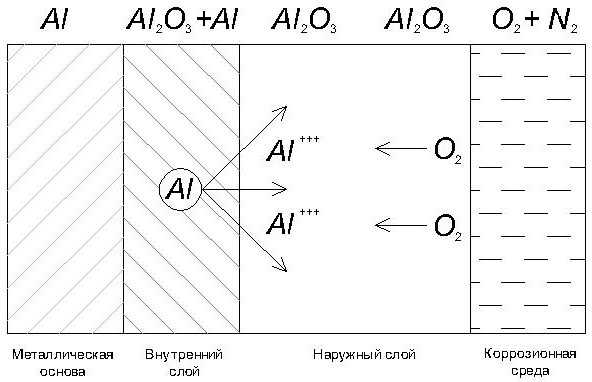 Рис.2. Механизм образования оксидной пленки на алюминии
Рис.2. Механизм образования оксидной пленки на алюминии
Методы защиты от коррозии
Особенно сильно коррозия проявляет себя во влажной среде, а так же при появлении т.н. «блуждающих» токов. Именно поэтому очень важно защищать поверхность алюминия с помощью покраски, анодировки, а стальные изделия, соприкасающиеся с ним необходимо оцинковывать, эмалировать или хотя бы обрабатывать грунтовкой в несколько слоев. Крепеж, применяемый в производстве алюминиевых конструкций должен быть как минимум оцинкованным, но желательно, а для фасадных конструкций просто необходимо, использовать крепеж из нержавеющей стали. Для антикоррозионной защиты алюминиевых конструкций применяют следующие методы:
Порошковая окраска
Порошковое покрытие представляет собой напыленный на поверхность изделия полимерный порошок, который запекается (полимеризуется) в специальной печи при определенной температуре, как правило 180-220°С. Технология порошковой покраски состоит из трех этапов:
- Поверхность алюминиевого профиля обезжиривают и удаляют с нее все загрязнения
- Напыляют слой порошковой краски
- Запекание (полимеризация) порошкового покрытия в печи.
Порошковая покраска алюминиевого профиля и фурнитуры для светопрозрачных конструкций не только защищает металл от коррозии, но так же позволяет покрасить конструкцию в любой цвет по шкале RAL.
Анодирование профиля
Анодированое покрытие – это покрытие, которое создает на поверхности профиля устойчивую и не растворимую в агрессивных средах плёнку из окисла алюминия.
Анодирование позволяет создать такую равномерную толщину плёнки нерастворимой окиси на поверхности, которая уже не позволит контактировать алюминию с внешней средой и происходить дальнейшему окислению.
Технология построена таким образом:
- Сначала профиль обезжиривают в кислоте (например, щавелевой).
- Промывают в чистой воде.
- Далее травление в щелочи для вытравливания поверхностных неравномерно окисленных слоев металла, вместе с которыми снимаются все инородные включения на поверхности.
- Промывка в чистой воде.
- Профиль погружается в ванну с раствором электролита. Здесь в течение 0,5-1,5 часов он подвергается анодированию. На поверхности профиля образуется пленка оксида алюминия.
- Далее для получения цветного анодирования профиль перемещается в ванну с раствором соли какого-либо металла через которые снова пропускается ток. Цветные оттенки профиля зависят от продолжительности обработки. Минимально профиль обрабатывают 45 секунд (светлое шампанское), максимально - 15 минут (черный).
- Изолирование (Ванна упрочнения поверхности) - процесс химического замещения, при котором окисел на поверхности металла превращается в химически более прочную гидратную форму, более устойчивую к воздействию окружающей среды и химических веществ. Покрытие приобретает особую прочность, стойкость к механическим повреждениям.
- В заключение проводится сушка и упаковка.
Защита от контакта с другими металлами
Для того, чтобы алюминий не соприкасался с металлами, с которыми он может составить гальваническую пару, необходимо применять весь крепеж только из нержавеющей или оцинкованной стали.
Все стальные элементы, на которые монтируется конструкция – кронштейны, опорные узлы, анкерные пластины и т.д. – должны быть оцинкованы или прогрунтованны в несколько слоев. Так же для устранения прямого контакта алюминия и стали применяют паронитовые, резиновые, битумные прокладки.
Алюминиевый профиль и фурнитура не должны непосредственно соприкасаться с деревом, цементом, камнем, кирпичом, бетоном, и т. д., особенно в условиях повышенной влажности. Во избежание коррозии в этих случаях необходимо тщательно покрывать эти материалы битумом или другим изоляционным материалом, деревянные детали необходимо пропитывать лаком.

Рис.3. Пример оцинкованного кронштейна с нержавеющим крепежом
Заключение
Алюминий имеет высокую стойкость к коррозии, однако, при контакте с другими металлами или при воздействии электрического тока подвержен коррозии. Мерами по защите алюминиевых светопрозрачных конструкций от коррозии являются нанесение порошкового покрытия или анодирование, а так же использование нержавеющего или оцинкованного крепежа и элементов конструкции.
Примечание
Использованы материалы:
Вклад участников
Грибов Сергей
Мой вклад в развитие этой Вики можно посмотреть здесь
www.wikipro.ru
Защитные пленки - Справочник химика 21
Таким образом, при совместном присутствии в нефтях хлоридов металлов и сероводорода во влажной среде происходит взаимно инициируемая цепная реакция разъедания металла. При отсутствии или малом содержании в нефтях хлористых солей интенсивность коррозии значительно ниже, поскольку образующаяся защитная пленка из сульфида железа частично предохраняет м( талл от дальнейшей коррозии. [c.143]
С фтором практически не реагируют или реагируют весьма незначительно инертные газы, фториды тяжелых металлов, фторопласты, а также висмут, цинк, олово, свинец, золото и платина. Медь, хром, марганец, никель, алюминий, нержавеющая сталь при отсутствии воды практически стойки в контакте с фтором вследствие образования на их поверхности прочной защитной пленки соответствующего фторида. [c.128]
Вследствие образования защитной пленки алюминий устойчив в очень разбавленной НЫОз и концентрированных растворах НЫОз и Н2Й04 на холоду. Склонность к пассивированию позволяет повысить коррозионную стойкость алюминия обработкой его гюверхности соответствующими окислителями (конц. НЫОз, КгСггО.) или анодным окислением. При этом толщина защитной пленки возрастает. Устойчивость алюминия позволяет использовать его для изготовления емкостей для хранения и транспортировки азотной кислоты. [c.452]
Из формулы видно, что с ростом величины капли скорость ее выпадения возрастает пропорционально квадрату линейных размеров капли. Однако основную роль в разрушении эмульсии играет не скорость выпадающих капель диспергированной фазы, а разрушение защитных пленок глобул и соединение их в крупные капли, которые выпадают с линейной скоростью, определяемой законом Стокса. На этом основан электрический метод — разрушение эмульсии в электрическом силовом поле между электродами. Гидрофобные эмульсии, состоящие из глобул воды в нефтяной среде, разлагаются электрическим током достаточно эффективно. Это обусловлено значительно более высокой электрической проводимостью воды (да еще содержащей соли) по сравнению с проводимостью нефти (проводимость чистой воды 4-10 , проводимость нефти 3- 10 з). [c.13]
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал— серебро, золото. Существуют различные способы нанесения металлических покрытий наибольшие преимущества имеют методы гальванотехники (см. 103). [c.559]
Подогреватель пропилена, смесительное сопло и реактор могут быть выполнены из обычной стали, так как в местах контакта с хлором образуется защитная пленка из кларенового углерода. НС1-Абсорбер лучше всего изготавливать из кирпича, пропитанного силикатом натрия, или из стойкого к химическим воздействиям камня. [c.181]
Защитные свойства нефтепродуктов могут быть улучшены только с помощью присадок — ингибиторов коррозии, способных к повышению смачивающей способности нефтепродуктов по отношению к металлам в системе нефтепродукт + вода, к торможению анодного, катодного (или одновременно катодного и анодного) процессов электрохимической коррозии и к образованию на поверхности металла, освобожденной от адсорбированной пленки воды, прочных адсорбционно-хемосорбционных защитных пленок. Эта закономерность более подробно рассмотрена в следующем разделе. [c.291]
В воде FeS нерастворим поэтому, накапливаясь на поверхности металла, сернистое железо играет до некоторой степени роль защитной пленки, предотвращающей дальнейшую коррозию. При взаимодействии FeS с соляной кислотой пленка превращается в хлорное железо, легко растворимое в воде. Наличие соляной кислоты способствует обнажению чистого металла, и его коррозия возрастает. Поэтому содержание солей в нефтях, выделяющих при переработке h3S, особенно опасно. Следовательно, сернистые нефти необходимо предварительно полностью обессоливать. Хлориды способствуют увеличению образования сероводорода при перегонке примерно в 2—3 раза. Сероводород (HgS) крайне ядовитый газ, вызывающий отравление обслуживающего персонала и загрязнение атмосферного воздуха. [c.10]
Ингибиторы коррозии, растворимые в нефтепродуктах (сульфонаты двухвалентных металлов, соли сульфокислот и карбамида, нитрованные нефтепродукты), образуют на металлах, как правило, прочные хемосорбционные защитные пленки. Они обладают высокой эффективностью при испытании в камере влажности и камере с диоксидом серы. Ингибиторы этого типа мало эффективны на начальных стадиях торможения коррозии в системе нефтепродукт + вода + металл незначительно изменяют межфазное натяжение на границе нефтепродукт — вода, практически не тормозят электрохимические процессы коррозии и, таким образом, значительно уступают ингибиторам первого типа по способности вытеснять электролит с поверхности металла. [c.297]
Действие этих присадок обусловлено образованием на трущихся металлических поверхностях различных по химическому составу защитных пленок. [c.28]
В процессе полимеризации эмульсия образует ячейки, напоминающие пчелиные соты, внутри которых закупорен сжиженный газ. Вся масса принимает свойства твердого тела. Для уменьшения потери горючего за счет испарения и предохранения от внешних повреждений брикет поливают поливиниловым спиртом, образующим после высыхания прочную не пропускающую газ защитную пленку. Готовые брикеты хранят в засыпных ямах. Хранение сжиженных газов в отвержденном состоянии является наиболее безопасным, не требует расхода металла, дорогостоящего оборудования, арматуры и предохранительных устройств. [c.293]
Вода является обычным спутником сырой нефти. Она может содержаться в нефти либо в виде простой взвеси и тогда легко отстаивается, либо в виде эмульсии, защитные пленки которой могут быть образованы солями нафтеновых кислот, смолистыми веществами, частицами глины и т. д. В этом случае приходится прибегать к особым методам обезвоживания. [c.188]
Можно полагать, что торможение окисления сернистыми соединениями больше обусловлено их способностью пассивировать каталитическое действие металлов вследствие образования защитной пленки, чем непосредственным воздействием этих соединений на окислительные цепи. [c.90]
Каталитическое действие металла практически прекращается, если он покрывается пленкой, образованной продуктами окисления. Следовательно, в работающих двигателях и механизмах роль катализаторов играют главным образом трущиеся поверхности, с которых защитная пленка непрерывно удаляется при контакте. [c.196]
Адсорбционная способность присадок. Адсорбция присадок на границе раздела фаз является первичным актом взаимодействия среды с поверхностью трения. Адсорбция характеризует накопление в граничном слое вещества, способного при прочих равных условиях определять протекание дальнейших процессов, связанных (в зависимости от назначения присадки) с формированием прочной защитной пленки либо химически модифицированного поверхностного слоя. Под адсорбцией в данных случаях понимается адсорбция в электрически нейтральной форме (физическая адсорбция) и адсорбция с обменом зарядами (хемосорбция), тем более что во многих случаях четкую грань между этими двумя формами адсорбции провести невозможно [274]. [c.255]
ПО отношению к металлам в системе нефтепродукт вода (уменьшают силу катодного тока), тормозят анодный процесс ионизации металла. Соединения этого типа обладают высокой способностью вытеснять с поверхности металла агрессивные электролиты. Однако они не образуют на металле прочных защитных пленок и обладают малой защитной способностью при испытаниях в камере влажности. [c.297]
Полимеризация протекает в присутствии катализаторов. В зависимости от условий полимеризации получают полипропилен, различающийся по структуре макромолекул, а следовательно, и па свойствам. По внешнему виду это каучукоподобная масса, более или менее твердая и упругая. Отличается от полиэтилена более высокой температурой плавления. Например, полипропилен с молекулярной массой выше 80 000 плавится прн 174—175 °С. Используют полипропилен для электроизоляции, для изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Последнее прим е-няют в производстве канатов, рыболовных сетей и др. Пленки нз полипропилена значительно прозрачнее и прочнее полиэтиленовых, пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию. [c.501]
Нагрев эмульсий ускоряет их разрушение, так как ири атом возрастает растворимость в нефти защитной пленки эмульгатора, уменьшается вязкость среды и увеличивается разность плотностей. [c.179]
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород [c.636]
Покрывающая поверхность металла защитная пленка из ГеЗ частично предохраняет металл от дальнейшей коррозии, но при наличии хлористого водорода защитная пленка разрушается, так как сернистое железо вступает в реакцию [c.177]
Неэлектролиты, применяемые в качестве деэмульгаторов, — это органические соединения, способные растворять защитную пленку эмульгатора, понижать вязкость нефти и тем самым способствовать осаждению частиц воды. К ним относятся бензол, сероуглерод, ацетон, спирты, фенол, эфиры, бензин и др. Эффективным деэмульгатором является фенол — весьма стойкие эмульсии разрушаются при добавлении его в количестве всего 0,01%. Неэлектролиты в промышленных условиях не применяются из-за их высокой стоимости. [c.182]
В основе действия большинства противокоррозионных присадок лежит образование защитных пленок. Защитная пленка может создаваться как в результате химического взаимодействия присадки с металлом, так и за счет поверхностно-активных свойств присадки, образующей слой (барьер) вследствие ориентированной адсорбции полярных групп [23]. Образование таких защитных пленок является, по существу, также коррозионным процессом, поэтому применение этих присадок возможно при условии, что [c.306]
При обычной температуре металлы коррозионноустойчивы на во .духе, что объясняется наличием на их поверхности защитной пленки ЭО2. При нагревании же их активность заметно возрастает. Так, при температуре красного каления они сгорают в кислороде, образуя ЭО2. При 800° С активно реагируют с азотом, образуя 3N. С галогенами взаимодействуют при 150—400° С, образуя ЭНа14, и г. д. В порошкообразном состоянии металлы пирофорны. [c.530]
Н.1ходясь в ряду напряжений далеко впереди водорода, лантаноиды окисляются водой, особенно горячей, выделяя водород. Тем более активно они взаимодействуют с кислотами. В ИР и НдРО лантаноиды устойчивы, так как покрываются защитными пленками нерастворимых солей. В щелочах не растворяются. [c.643]
Содержащиеся в оборотной воде соли и другие примеси вызывают коррозию оборудования. Хлориды ускоряют коррозию вследствие увеличения кислотности воды и их разрущающего действия на пассивирующие пленки сульфаты агрессивно действуют на бетон. Диоксид углерода замедляет образование защитных пленок. Для защиты от коррозии в оборотных системах применяют различные ингибиторы. Процесс коррозии приостанавливают хромат и бихромат калия. Они же замедляют биологические обрастания. Для снижения коррозии воду обрабатывают также фосфатами, которые образуют пленку, изолирующую металл от воды. В отличие от хроматов фосфаты благоприятствуют развитию биологических обрастаний, поэтому эти химикаты иногда применяют совместно. Один из способов защиты металла от коррозии — защитные покрытия смолами, красками, лаками и эмалями, однако они недолговечны и восстановить их можно только во время ремонта. [c.86]
Из приведенных данных видно, что при достаточно большой поверхности металла, контактирующего с топливом, 25—30% вторично-октилмеркаптана взаимодействуют с металлом значительная часть продуктов окисления остается в топливе в виде нерастворимого осадка, в состав которого входит 2—5% общего количества серы. На поверхности бронзы не образуется заметной защитной пленки. Под микроскопом видны следы разрушитель-1Г0Й деятельности вторичного октилмеркаптана (рис. 12). Поверхность бронзы как бы выедается, причем продукты взаимодействия вторично-октилмеркаптана с металлол не остаются на поверхности бронзы, а переходят в топливо в виде осадка. [c.91]
Влияние катализатора может сказываться не только на скорости окисления и длительности индукционного периода, но и на внутристадийном превращении одних продуктов окисления в другие, а также на характере конечных продуктов [101]. По некоторым данным, металлы катализируют окисление в основном в тех случаях, когда они образуют соли с кислотами. Чаще всего это происходит в присутствии воды и кислорода воздуха. Каталитическое действие металла прекращается, если он покрывается защитной пленкой, создаваемой продуктами окисления. Большая часть исследователей считает, что основную роль в катализирующем действии солей оказывает катион [96]. При этом, однако, соли одного и того же металла, но разных кислот могут обладать неодинаковой катализирующей активностью, т. е. активность солей может зависеть не только от катиона, но и от аниона. Анион может и не оказывать принципиального действия, а может влиять, например, на растворимость соли в масле и таким образом косвенно воздействовать на эффективность металлического катализатора. [c.77]
При высоких температурах и особенно при высоких удельных нагрузках возможно заметное нарущенгие граничных слоев смазки. В этом случае сила трения представляется как сумма четырех слагаемых Рек, Рсух, Рм и Рср, из которых Рем — составляющая, реализуемая в смазочном слое, а /сух, Рм и Рс-д — при соударении микронеровностей. При этом если с поверхности трения удаляются защитные пленки и происходит непосредственный контакт микронеровностей по сухим верщинам, Фо имеет место Рсух, при большой нагрузке, когда в микроконтакте возникают высокие температуры и отдельные микронеровности одного или другого металла могут расплавиться, преобладает Рм при сильном пластическом деформировании, когда образуются мостики сварки между контактируемыми неровностями двух сопряженных тел, имеет место Рср [257]. [c.241]
Для указанных трущихся деталей (пара трения кулачок-толкатель) характерны высокие контактные напряжения (до 3000— 7500 кг/см ) и усталость их поверхности в связи с циклически повторяющимся воздействием высоких напряжений. В этих условиях наиболее эффективны диалкилдитиофосфаты цинка, которые при умеренной температуре распадаются на продукты, взамодей-ствующие с металлом поверхности толкателей и образующие на поверхностях трения защитные пленки [37, 38]. При высоких рабочих температурах и умеренных нагрузках, например в зоне первого поршневого кольца, наблюдается превосходство более термоустойчивых диарилдитаофосфатов цинка [24, 37]. Так, при испытании в одноцилиндрово М дизеле масла с диарилдитиофосфатом цинка износ хромированных поршневых колец был более чем в [c.165]
По мнению большинства экспериментаторов, исследовавших действие моющих присадок, присадка ЦИАТИМ-339 способствует образо1ванию на поверхности металла и на частицах твердых продуктов окисления защитной пленки, препятствующей слипанию частиц и их прилипанию к металлу. [c.312]
Эффективный способ устранения подвулканизации смесей — экранирование поверхности частиц соединения металла защитной пленкой. Например, описан способ повышения стабильности резиновых смесей за счет использования окиси цинка, покрытой сульфидом цинка, и окиси цинка, покрытой фосфатом цинка [8]. Применение органических кислот и их ангидридов в качестве замедлителей реакции солеобразования с окисью цинка снижает подвулканизацию смесей карбоксилсодержащих каучуков и одновременно существенно улучшает свойства вулканизатов [8]. Применение в качестве вулканизующих агентов алкоголятов алюминия, магния, а также различных перекисей двухвалентных металлов (Zn02, ВаОг и др.) позволяет существенно повысить стойкость резиновых смесей к подвулканизации [7]. Особенностью карбоксилсодержащих каучуков является повышенная стойкость в процессе теплового старения, очень высокое сопротивление разрастанию трещин (больше 300 тыс. циклов) [1]. По комплексу свойств карбоксилсодержащие каучуки представляют существенный интв--рес для различных областей применения. [c.403]
Металлический титан плавится при 1665 °С плотность его равна 4,505 г/смЗ. Титан — довольно активный металл стандартный электродный потенциал системы Ti/Ti + равен —1,63 В, Однако благв-даря образованию па поверхности металла плотной защитной пленки титан обладает исключительно высокой стойкостью против коррозии, превышающей стойкость нержавеющей стали. Он не окисляется на воздухе, в морской воде и не изменяется в ряде агрессивных химических сред, в частности в разбавленной и концентрированной азотной кислоте и даже в царской водке. [c.649]
Клетки дермы шктоянно делятся. Некоторые из вновь образовавшихся клеток при этом выталкиваются наружу, образуя эпидермис - внешний слой кожи. По мере выталкивания клеток их ядра умирают, а жидкость заменяется белковыми нитями. Жир, выделяемый железами, образует защитную пленку на их поверхности, поддерживая мягкость кожи и предотвращая избыточную потерю воды. Жировой слой слабокислый, так как белковые волокна разрушаются сюнованиями. [c.469]
По кинетическому механизму действия противокоррозионные присадки подразделяются на иммунизаторы, ингибиторы и пасси-ваторы [30]. К иммунизаторам относят вещества, при добавлении которых к бензинам удлиняется период-индукции до начала интенсивной коррозии ингибиторы замедляют скорость коррозии, но не увеличивают индукционный период, а пассиваторы предотвращают коррозию в самом начале, образуя защитную пленку продуктов коррозии на поверхности металла [44]. В качестве противокоррозионных присадок к бензинам исследованы и предложены многие вещества самых различных классов [51—61]. [c.306]
При низких температурах эти металлы покрыты защитной пленкой оксида и поэтому оказываются более инертными, чем можно судить по их окислительным потенциалам. У верхнего представителя этой группы оксид УзОд обладает амфотерными свойствами, подобно Т102. Он растворим и в кислотах, и в основаниях, образуя при этом сложные полимеры с плохо различимыми свойствами. В состоянии окисления +4 ванадий также образует соединения, которые проявляют свойства, промежуточные между ионными и ковалентными УС14-молекулярная жидкость с температурой кипения 154 С. В отличие от этого соединения У(П1) имеют ионный характер. [c.441]
Химия коллоидных и аморфных веществ (1948) -- [ c.259 ]Практикум по физической химии изд3 (1964) -- [ c.341 ]
Охрана труда и противопожарная защита в химической промышленности (1982) -- [ c.234 ]
Теория коррозии и коррозионно-стойкие конструкционные сплавы (1986) -- [ c.0 ]
Коррозия химической аппаратуры и коррозионностойкие материалы (1950) -- [ c.72 , c.77 , c.104 , c.107 , c.109 , c.114 , c.126 , c.147 , c.158 , c.182 ]
Эмиссионный спектральный анализ атомных материалов (1960) -- [ c.280 ]
Оборудование производств Издание 2 (1974) -- [ c.13 ]
Практикум по физической химии Изд 3 (1964) -- [ c.341 ]
chem21.info
Поверхность - алюминий - Большая Энциклопедия Нефти и Газа, статья, страница 2
Поверхность - алюминий
Cтраница 2
Поверхность алюминия в условиях эксплуатации легко чистится и не разрушается. [16]
Поверхность алюминия всегда покрыта прочной окисной пленкой, которая вследствие ее тугоплавкости и большого удельного веса значительно затрудняет процесс сварки. Для удаления этой пленки и предохранения от опасности образования новых окислов алюминия при нагреве необходимо применять различные способы очистки изделий перед сваркой и специальные флюсы или электродные покрытия в самом процессе сварки. [17]
Поверхность алюминия и его сплавов покрыта тугоплавкой оксидной пленкой, плавящейся при температуре 2050 С. Эта пленка очень затрудняет сплавление основного и присадочного металлов, поэтому свариваемые кромки необходимо тщательно очистить механическим или чаще всего химическим способом. С прочность алюминия резко падает и деталь может разрушиться даже под действием собственного веса. [18]
Поверхность алюминия покрыта естественной окисной пленкой толщиной 0 02 - 0 04 мк. Такая пленка не может служить надежной защитой против коррозии. С помощью электрохимического оксидирования можно значительно увеличить толщину пленки и улучшить ее физико-химические и механические свойства. [20]
Поверхность хорошо травленного алюминия должна иметь матово-серый цвет с равномерно распределенными участками, имеющими металлический блеск. Равномерно серый или черный цвет поверхности свидетельствует о слишком интенсивном травлении, что часто означает перетравливание и переход через оптимальный режим, обеспечивающий максимальное увеличение поверхности. [21]
Светлая мелкозернистая поверхность алюминия, аналогичная сатинированной, может быть получена травлением в растворе, содержащем 160 - 260 г / л едкого натра, 160 - 260 г / л нитрата натрия, 120 - 160 г / л нитрита натрия, 50 - 80 г / л тринатрий-фосфата, 0 5 - 1 0 г / л декстрина. Для улучшения качества травленой поверхности в раствор добавляют 40 - 50 г / л глюконата натрия. Температура раствора 70 - 80 С, продолжительность обработки в зависимости от требований к внешнему виду 0 5 - 20 мин. В табл. 4.28 приведены составы растворов для травления алюминия и его сплавов и режимы обработки. [22]
На поверхности алюминия в естественных условиях всегда присутствует пленка А12О3 толщиной ( 5 - i - 15) 10 3 мкм. [23]
На поверхности алюминия и его сплавов при 20 С образуется окисел AlzOs, который состоит из двух слоев. Наружный слон так называемый, воздушио-окисиой пленки состоит из более проницаемого, пористого окисла, толщина которого зависит от продолжительности реакции и влажности окружающей среды. При небольших выдержках при 500 С еще происходит образование аморфного окисла н требуется 2 - 4 ч, чтобы окисел начал переходить частично в кристаллическое состояние. Этот окисел стехиометрический, плотный, защищающий алюминий от окисления. При зарождении окисной пленки во влажной среде на поверхности алюминия мгновенно образуется пленка байернта ( АЬОз-НгО), а также гидрат окиси алюминия. Окислы - гидраты А12Оэ - Н2О ( диспор, бемит) являются стехнометрическими и плотными. [24]
На поверхности алюминия и его сплавов образуются пленки, обладающие высокими защитными свойствами ( окислы типа А12Оз), и возможность применения этих сплавов определяется в основном не их жаростойкостью, а их жаропрочностью при рабочих температурах. [25]
На поверхности алюминия, покрытого малоэлектропроводной защитной пленкой, существуют три типа участков: 1) участки, покрытые относительно толстой пленкой, изолирующей поверхность; 2) участки, покрытые пленкой малой толщины, доступной для прохождения электронов, но непроницаемой для ионов, могущие быть катодами; 3) лоры и трещины, в которых ток может проходить в любых направлениях; только на этих участках ионы металла могут переходить в раствор. [26]
На поверхности алюминия всегда присутствует естественная защитная оксидная пленка, однако ввиду малости ее толщины она может оказаться недостаточной защитой. Наиболее эффективным способом защиты алюминия и его сплавов от коррозии является их химическое или электрическое оксидирование ( анодирование) в сочетании с лакокрасочными покрытиями. Лучшие результаты показывают анодирование в сочетании с фосфатным оксидированием. [28]
Подготовляют поверхности алюминия и его сплавов перед пайкой не позже, чем за 3 суток. [29]
На поверхности алюминия также образуется тонкая плотная беспористая пленка, рост которой вызывает росч напряжения, обеспечивающего диффузию ионов через пленку. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Анодирование сплавов алюминия — Гальванические покрытия
Анодирование (оксидирование) электрохимическое оксидирование, образование защитной оксидной плёнки на поверхности металлических изделий электролизом. При анодировании изделие, погруженное в электролит, соединяют с положительно заряженным электродом источника тока (анодом). Плёнка толщиной от 1 до 200 мкм защищает металл от коррозии, обладает электроизоляционными свойствами и служит хорошей основой для лакокрасочных покрытий.Анодирование применяют для декоративной отделки изделий из алюминия и его сплавов, эмалеподобных покрытий на алюминии и некоторых его сплавах, а также используют для защиты от коррозии магниевых сплавов, повышения антифрикционных свойств титановых сплавов, для покрытия деталей радиоэлектронной аппаратуры из ниобия, тантала и др., в самолёто-, ракето- и приборостроении, радиоэлектронике.Сразу после механической обработки алюминий взаимодействует с кислородом воздуха, поэтому при нормальных условиях поверхность всегда покрыта тонкой оксидной пленкой. Структура пленки и ее состав зависят от воздействия атмосферных явлений. Но алюминий всегда имеет оксидную пленку толщиной 2-3 нм. Эта пленка защищает металл от дальнейшего окисления и обладает превосходной электропроводностью. Оксидная плёнка образуется на чистом алюминии, при комнатной температуре и имеет аморфную структуру (не кристаллическую) и поэтому не является хорошей коррозионной защитой.
Защита алюминия от коррозии реализуется путем создания на его поверхности кристаллической оксидной пленки толщиной 20-30 микрон. На следующих этапах процесса оксидирования алюминия эта пленка может быть окрашена или может сохранить естественный цвет.Оксидирование алюминия позволяет так же получить различные декоративные эффекты, такие как зеркальная поверхность, матовая и полуматовая поверхность, имитация полированной и шлифованной нержавеющей стали.
Прежде чем приступить к процессу оксидирования алюминия необходимо очистить поверхность алюминия от загрязнений и убрать оксидную пленку. Для этого проводят процессы обезжиривания и травления.
Процесс, в результате которого, происходит образование на поверхности металла высокопористых оксидных слоев алюминия. Процесс оксидирования алюминия является электрохимическим.
Существуют два вида оксидных пленок, которые образуются в процессе анодирования — барьерная и пористая.
Барьерная — оксидная пленка растет в нейтральных растворах, в которых оксид алюминия трудно растворим. Преимущественно это бораты аммония, фосфаты или тартраты.
Пористая– оксидная пленка растет в кислых электролитах , в которых оксид может не только осаждаться, но и растворяться. Наиболее широко используется разбавленная серная кислота Н2SO4 . Можно также использовать щавелевую и фосфорную кислотыты.
В первые секунды анодирования на алюминии образуется барьерный слой, сначала формирующийся в активных центрах на поверхности металла. Из этих зародышей вырастают полусферические линзообразные микроячейки, срастающиеся затем в сплошной барьерный слой. При соприкосновении с шестью окружающими ячейками образуется форма гексагональной призмы с полусферой в основании. Под влиянием локальных воздействий ионов электролита в барьерном слое зарождаются поры (в центре ячеек), число которых обратно пропорционально напряжению. В поре толщина барьерного слоя уменьшается, и, как следствие, увеличивается напряженность электрического поля, при этом возрастает плотность ионного тока вместе со скоростью оксидирования. Но, поскольку растет и температура в поровом канале, способствующая вытравливанию поры, наступает динамическое равновесие, и толщина барьерного слоя остается практически неизменной.
На этом процесс анодирования заканчивается, мы получаем покрытие с замечательными оптическими и технологическими свойствами.
Коврик антискользящий купить
Покрытые изделия могут служить десятилетиями без изменения своих декоративных свойств. Анодная защита от коррозии настолько эффективна, что может защитить детали от самых агрессивных воздействий. Эти замечательные свойства давно оценили производители автомобилей, строители, военные, авиапроизводители.
Поделиться ссылкой:
Понравилось это:
Нравится Загрузка...
dneprof.com
Окисная пленка - алюминий - Большая Энциклопедия Нефти и Газа, статья, страница 2
Окисная пленка - алюминий
Cтраница 2
Применяют при пайке алюминия и его сплавов для растворения окисной пленки алюминия в процессе пайки. [16]
Защитное действие достигается за счет того, что диффузия сквозь окисную пленку алюминия или шпинели РеО - А12О3 происходит значительно медленнее, чем в окислах железа. [18]
Известно, что на практике пока не существует активных газовых сред, восстанавливающих окисную пленку алюминия А12О3 при высокотемпературной пайке. [19]
Вследствие перестройки кристаллической решетки и изменения физических свойств при нагреве до температуры пайки в окисной пленке алюминия возможны местные нарушения ее сплошности и другие дефекты, по которым может происходить контакт паяемого металла с жидким припоем. [20]
Действие различных веществ на алюминий, в зависимости от их природы, разнообразно. Очень кислые и сильнощелочные среды разрушают нестойкую по отношению к ним окисную пленку алюминия и после ее ликвидации растворяют металл с выделением водорода. В отдельных случаях, однако, алюминий проявляет поразительную стойкость в концентрированных кислотах: например, азотная кислота высокой концентрации может привести к пассивации поверхности. [21]
Действие различных веществ на алюминий, в зависимости от их природы, разнообразно. Очень кислые и сильнощелочные среды разрушают нестойкую по отношению к ним окисную пленку алюминия и после ее ликвидации растворяют металл с выделением водорода. В отдельных случаях, однако, алюминий проявляет поразительную стойкость в концентрированных кислотах: например, азотная кислота высокой концентрации может привести к пассивации поверхности. [22]
Эта гидроокись магния может иметь и другое применение. Аналогичная ей гидроокись алюминия тчАЮОН, также возникающая в горячих водных условиях, оказывается хорошим защитным материалом на поверхности алюминия и его сплавов, чем часто пользуются для закупорки тонких пор в окисных пленках алюминия. Оказывается, что описанная здесь и в оригинальной работе [18] гидроокись магния присутствует на поверхности именно в тех случаях, когда поверхность магния подвержена наименьшей коррозии. [23]
Коррозионная стойкость свинца объясняется образованием на его поверхности окисных пленок. Если при эксплуатации освинцованной аппаратуры эта пленка повреждается, то кислота, контактируя с металлом, разъедает его, а новая пленка окисла при этом образоваться не успевает. Окисная пленка алюминия имеет сравнительно небольшой защитный эффект и хорошо противостоит действию только некоторых кислот, например разбавленной азотной. Серная, концентрированная азотная и соляная кислоты, а также щелочь легко разрушают окись алюминия, что в сочетании с низкой механической прочностью алюминия значительно ограничивает применение этого металла в коррозионных средах. [24]
Алюминий отличается весьма высокой химической активностью. Он легко окисляется за счет не только кислорода воздуха, но и составляющих футеровки. Окисная пленка алюминия обладает повышенной плотностью, которая предохраняет его от дальнейшего окисления. Поэтому алюминий является одним из коррозионно-стойких металлов. Однако образовавшаяся окись при реакции алюминия с кислородом атмосферы или из футеровки может остаться внутри металла, что вызовет понижение качества отливки. [25]
Оксидирование алюминия и его сплавов165 широко применяется для защиты от коррозии. Искусственные окисные пленки служат прекрасной грунтовкой, хорошо адсорбируют красители и в ряде случаев окрашиваются в красивые цвета для декоративных целей. Окисные пленки алюминия, гндратированные в большей или меньшей степени, имеют микропористую структуру. Толщина пленки обычно составляет 3 - 20 мкм; такая пленка надежно защищает от коррозии, особенно после пропитки ее наполнителями: жаростойкость пленки достигает 15 () 0 С, а теплопроводность 0 001 - 0 003 кал. Оксидная пленка обладает большой твердостью и высокими электроизоляционными свойствами. [26]
Алюминий отличается весьма высокой химической активностью. Он легко окисляется за счет не только кислорода воздуха, но и составляющих футеровки. Окисная пленка алюминия обладает повышенной плотностью, которая предохраняет его от дальнейшего окисления; поэтому считается, что алюминий является одним из коррозионно стойких металлов. Однако образовавшаяся окись при реакции алюминия с футеровкой может остаться внутри металла, что вызовет понижение качества отливки. [27]
Разрушенный механически окисел на поверхности алюминия быстро восстанавливается на воздухе. Таким образом, обычной зачистки до металлического блеска при опрессовке алюминия недостаточно. Поэтому во избежание образования окисной пленки алюминия при подготовке алюминиевых жил к опрессовке применяют кварцевазелиновую пасту. Паста состоит из равных количеств ( по массе) очищенного кварцевого песка и технического вазелина. Свойства пасты позволяют совместить функции удаления окисла и защиты от окисления в последующем. [28]
Специальные латуни, содержащие различные элементы, имеют определенные свойства и строение сплава. Введение в сплав до 4 % А1 позволяет обрабатывать давлением латунь, увеличивает твердость, прочность и предел текучести. Антикоррозийные свойства повышаются за счет образования окисной пленки алюминия, защищающей поверхность латуни от действия атмосферы. [29]
Окисление алюминия на воздухе, а) Алюминий энергично окисляется на воздухе, если удалить с его поверхности пленку окиси алюминия и создать условия, при которых она не будет возникать. Через 2 - 3 мин алюминий вынимают из раствора нитрата ртути, промывают водой и протирают досуха бумагой. Алюминий вытесняет ртуть из ее соли, на поверхности образуется амальгама алюминия, препятствующая образованию плотной окисной пленки алюминия. Поэтому алюминий окисляется на воздухе, постепенно разрушается. [30]
Страницы: 1 2 3
www.ngpedia.ru
Алюминий не ржавеет: причины - Woman's Day
Если сплавы железа ржавеют относительно быстро, то при нормальных условиях алюминий практически не разрушается. На его поверхности появляется защитная пленка из оксида алюминия. Она имеет тонкий слой примерно 5−10 мм, но обладает высокой прочностью. Этот слой не позволяет влаге, воздуху разрушать структуру металла.
Как только нарушается целостность оксидной пленки, металл корродирует. Причинами повреждения защитного слоя может являться взаимодействие с кислотами, растворителями и щелочами, механическое воздействие (например, силы трения).
В промышленных районах и в городской среде оксидная пленка нарушается за счет продуктов распада топлива, взаимодействия с серой и с окислами углерода.
Интенсивно растворяют пассирующий слой такие элементы, как фтор, хлор, натрий, и соединения брома. Строительные растворы с добавлением цемента также приводят к быстрой порче металла. Морская вода также вызывает интенсивное разрушение чистого алюминия, поэтому на практике используют сплав с медью и марганцем, получивший название дюралюминия.
Гальванические пары способны вызывать электрохимическую коррозию. В местах соединений двух разнородных металлов ржавчина выступает наиболее заметно. При этом коррозии подвергается только один металл, а второй выступает в роли источника. Поэтому не рекомендуют использовать алюминиевые кузова при контакте с железом.
Следующие факторы замедляют и даже полностью приостанавливают процесс порчи металла:
1. Для сохранения антикоррозионных свойств алюминия значение имеет кислотно-щелочной баланс (pH) в диапазоне от 6 до 8 единиц.
2. Металл без примесей лучше справляется с агрессивной средой. Согласно экспериментам, сплав, состоящий на 90% из чистого алюминия, в 80 раз быстрее подвергается коррозии, чем сплав, который состоит на 99% чистого металла.
3. Дополнительный защитный слой помимо естественного сохраняет структуру металла даже в агрессивных средах. Для этого используют анодирование защитного слоя, покрытие специальными красками и полимерными составами.
4. Предотвратить появление ржавчины помогает добавление марганца на 3% в процессе производства алюминия.
www.wday.ru